의료기기 규제혁신 및 산업육성방안 후속조치
[세종=뉴스핌] 임은석 기자 = 앞으로 신의료기술평가와 보험등재심사가 동시에 진행돼 신개발 의료기기의 시장 진입이 100일 가량 빨라질 전망이다.
보건복지부는 이같은 내용을 담은 '신의료기술평가에 관한 규칙' 개정안을 9일부터 6월 16일까지 40일간 입법예고한다고 7일 밝혔다.
지금까지 새로운 의료기술이 포함된 신개발 의료기기의 보험등재를 위해서는 식픔의약품안전처 허가 이후에도 신청된 의료기술이 기존에 등재된 의료기술인지 여부가 불분명할 때 이를 확인하는 요양급여·비급여 대상확인과 신의료기술평가 등을 거쳐야 해 시장 진입이 늦어진다는 지적이 있었다.
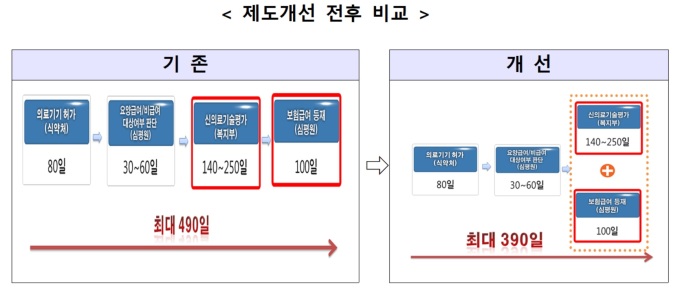
이번 '신의료기술평가 규칙' 개정안은 그동안 한국보건의료연구원과 건강보험심사평가원이 구성한 제도개선 협의체에서 협의된 내용을 바탕으로 신의료기술평가와 보험등재심사를 동시 진행해 신개발 의료기기의 시장 진입 기간을 단축하도록 하고 있다.
신의료기술평가 시, 한국보건의료연구원에 보험급여 등재를 위한 자료를 제출할 경우 건강보험심사평가원의 보험등재심사도 자동으로 진행된다.
이에 따라 신의료기술평가가 완료될 때 보험급여 등재심사도 종료될 수 있게 됨으로써, 의료기기의 시장 진입 기간이 기존 최대 490일에서 390일로 100일 가량 단축될 전망이다.
손호준 복지부 의료자원정책과장은 "신개발 의료기기의 시장 진입 기간이 100일 가량 단축됨에 따라, 그간 시장 진입 기간이 길어져 발생했던 업계의 어려움이 상당부분 해소될 것"이라고 말했다.
한편, 이번 개정안에 대해 의견이 있는 단체 또는 개인은 6월 16일까지 복지부 의료자원정책과로 의견을 제출하면 된다. 복지부는 입법예고 기간 중 국민의 의견을 폭넓게 수렴한 후 개정안을 확정할 예정이다.
fedor01@newspim.com