뇌종양 병변 완전 소실·안정성도 '긍정'
식약처, 희귀의약품 지정…상용화 속도↑
전문가 "새로운 치료 패러다임 제시해"
[세종=뉴스핌] 신도경 기자 = 저용량 투여로 종양의 77%를 줄이는 4세대 비소세포폐암 신약 후보 'JIN-A02'가 차세대 폐암 치료제 대표 주자로 급부상하고 있다.
31일 정부와 바이오 업계에 따르면, 식품의약품안전처는 제이인츠바이오(J INTS BIO)의 4세대 비소세포폐암 신약 후보 'JIN-A02'를 국가 지정 개발단계 희귀의약품으로 공식 선정했다.
◆ 차세대 폐암 신약 JIN-A02, 종양 77% 감소 효과…임상 단계 '돌입'
'JIN-A02'에 대한 희귀의약품 선정은 국내에서 개발 중인 4세대 상피세포 성장인자 수용체(EGFR) 표적항암제 중 유일한 인정 사례다. EGFR은 상피세포의 성장, 사멸을 조절해 비소세포성 폐암 등 특정 암에서 중요한 역할을 한다.
'JIN-A02'는 돌연변이 양성의 진행성 또는 전이성 비소세포폐암 치료를 목표로 하는 억제제다. 한국·미국·태국 등에서 다국가 임상 시험에 돌입한 상태다. 항암 효과를 분석한 결과, 저용량(50mg) 투여 환자 1명은 종양이 77% 감소했다. 100mg 투여군에서 뇌 병변이 감소하고 300mg 고용량 환자 중 일부는 뇌종양 병변이 완전 소실되는 결과도 나타났다.
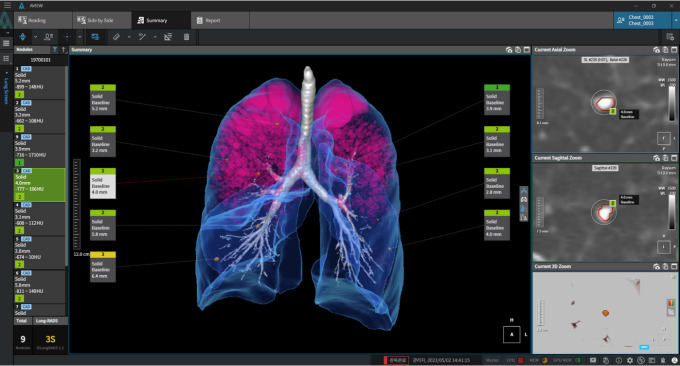
안정성도 긍적적인 결과가 나왔다. 용량제한독성(DLT)이나 중증 이상 반응이 보고되지 않았고 발진·설사 등 경미한 부작용만 발생해 모두 관리 가능한 수준이었다. EGFR 삼중돌연변이 환자 1명은 21개월 이상 안정적으로 치료를 유지했다.
문제는 치료 후 나타나는 내성 반응이다. 제이인츠바이오는 병용 치료를 통해 장기간 종양 감소 효과를 높일 예정이다. 조병철 연세암병원 종양내과 교수 등은 병용 치료 중심의 내성 극복 전략을 마련할 계획이다.
조 교수는 "EGFR 내성 폐암의 해법은 단일 표적을 넘어선 병용 전략에 있다"며 "JIN-A02는 내성 기전을 다각도로 제어할 수 있는 구조적 강점을 지닌 만큼, 여러 치료제와의 병용 임상을 통해 새로운 치료 패러다임을 제시할 잠재력이 높다"고 평가했다.
◆ 식약처, 희귀의약품으로 지정…허가 절차 간소화로 상용화 박차
식약처의 지정으로 'JIN-A02'는 임상시험계획(IND) 심사의 신속 진행, 허가 절차의 간소화, 연구개발비 세액공제 등의 혜택을 받는다. 'JIN-A02'는 희귀의약품으로서 조건부 승인 요건의 약 70% 이상을 이미 충족해 중간 결과만으로도 조기 상용화가 가능해졌다. 개발 기간이 단축되면 비용 부담이 줄고 상업화에 대한 위험을 줄이는 '일석이조'의 효과가 나타난다.
업계 전문가들은 "희귀의약품 지정은 단순한 명칭 이상의 의미를 지닌다"며 "국가가 직접 치료 필요성을 인정하고 제도적 지원을 보장함으로써 JIN-A02가 글로벌 임상 경쟁 속에서도 확실한 정책적 우위를 점한 사례"라고 평가했다.

보건복지부, 과학기술정보통신부, 산업통상자원부가 공동 추진하는 국가신약개발사업(KDDF)에도 선정됐다. KDDF는 글로벌 신약 창출을 목표로 2조2000억원을 투입하는 대규모 사업이다.
JIN-A02는 KDDF가 주관하는 '2025년 1차 임상 개발 지원 과제'에 선정돼 정부의 직접적인 연구개발(R&D) 지원을 받는다. 제이인츠바이오는 임상 2상 진입을 위한 연구비와 함께 국내외 규제 대응, 임상 설계 자문, 기술 사업화 등 다방면의 지원을 확보했다.
업계에 있는 한 전문가는 "JIN-A02를 국가 인증 신약 파이프라인으로 확립하는 계기"라며 "글로벌 협력과 투자 유치를 이루는 자산이 될 것"이라고 설명했다.
sdk1991@newspim.com