고밀도 골형성 유도·부작용 최소화 기술력 인정..."유럽·호주 등 글로벌 진출 가속화"
[서울=뉴스핌] 김영은 인턴기자 = 바이오 재생의료 전문기업 시지바이오가 미국 식품의약국(FDA)으로부터 차세대 골대체재 '노보시스 퍼티(Novosis Putty)'에 대한 '임상시험계획 승인(IDE)'을 받았다고 21일 밝혔다.
이번 승인은 미국 현지 기준으로 16일 이뤄졌다. 시지바이오는 철저한 비임상시험과 사전 인체임상(Pilot Study) 결과를 바탕으로 제품의 기술력과 안전성을 입증하며 IDE 승인을 확보했다. 회사는 이번 IDE 승인으로 미국 시판 허가(PMA)를 위한 마지막 임상 절차인 확증임상(Pivotal Study)에 본격적으로 착수하게 됐다. 확증임상은 미국 의료기기 시장 진입을 위한 핵심 단계로 꼽힌다.
노보시스 퍼티는 시지바이오의 기존 대표 제품 '노보시스(Novosis)'를 기반으로 개발된 차세대 골대체재다. 구조적 안정성과 사용 편의성을 모두 갖춘 것이 특징이다. 특히 시지바이오의 독자 기술인 서방형 제형 기술(SLOREL™')이 적용됐다. 이를 통해 새로운 뼈 생성을 돕는 골형성 단백질(rhBMP-2)의 방출 속도와 효율을 정밀하게 조절할 수 있다. 이 기술은 고밀도 골 형성을 유도하면서도, 이소성 뼈 생성(원치 않는 부위에 뼈가 생기는 이상반응) 등 부작용을 최소화하는 데 효과적이다. 해당 효과는 이미 국제학술지 'Journal of Clinical Medicine'에 인체임상 결과로 발표돼 기술 신뢰성을 입증받았다.
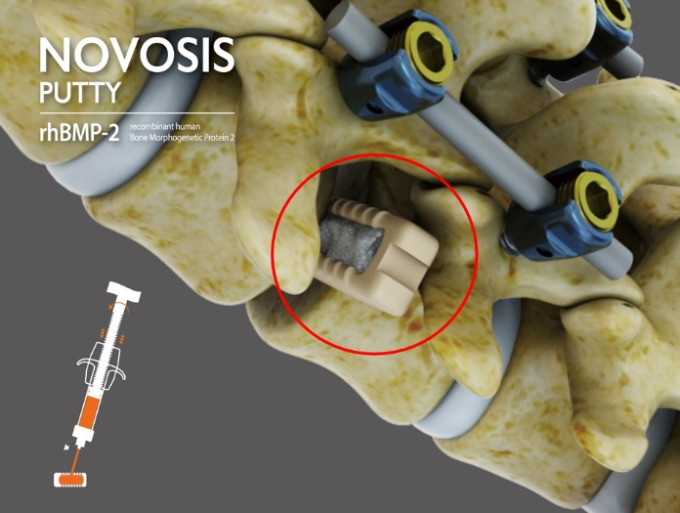
노보시스 퍼티는 한국에서 개발된 바이오융복합 의료기기 중 최초로 FDA로부터 확증임상 승인을 받은 사례이기도 하다. 2023년에는 FDA로부터 혁신의료기기(Breakthrough Device)로 지정되며 기술력을 먼저 인정받았다.
미국 골대체재 시장은 연간 약 1조원 규모로, 이번 IDE 승인은 시지바이오의 고부가가치 시장 진입을 위한 본격 출발점이란 점에서 의미가 크다.
시지바이오는 대웅제약 관계사로, 연구개발부터 생산·품질관리까지 대웅제약과 긴밀한 협력 체계를 구축하고 있다. 이번 IDE 승인 역시 양사 간 공조를 바탕으로 철저히 대응한 결과라고 회사 측은 설명했다.
한편 현재 시지바이오는 일본 파트너사인 니혼조끼를 통해 일본 현지에서 노보시스 퍼티 임상시험을 진행 중이다. 최근 일본에서 초기 안전성과 유효성을 평가하는 1/2상 임상 시험을 성공적으로 마쳤다. 노보시스 퍼티는 미국을 비롯한 선진국 시장을 타깃으로 개발된 제품으로, 이번 IDE 승인을 기점으로 유럽, 호주 등 주요 시장으로의 진출도 본격화할 계획이다.
한주미 시지바이오 미국법인 개발센터장은 이날 "FDA가 요구하는 엄격한 기준을 충족해 확증임상 개시 승인을 받게 된 것은 시지바이오의 기술력과 품질 시스템이 글로벌 수준에 부합함을 보여주는 신호"라며 "이제부터는 가장 빠르게 우리 제품이 미국과 선진 글로벌 시장에 진입할 수 있도록 모든 역량을 다해 개발에 박차를 가하겠다"고 밝혔다.
유현승 시지바이오 대표는 "이번 IDE 승인 획득은 시지바이오가 수년간 축적해온 기술 기반 개발 전략의 중요한 결실"이라며 "특히 미국 내 바이오융복합 골대체재 시장은 진입장벽이 매우 높은 분야로, 이번 승인 자체가 시지바이오의 기술력과 노보시스 퍼티 제품 경쟁력을 국제적으로 다시 한번 입증한 사례"라고 말했다.
이어 "시지바이오는 앞으로도 다양한 바이오융복합 의료기기 제품으로 환자 삶의 질을 높이는 혁신적 치료 옵션을 제공해 세계 의료기기 시장에서 의미 있는 변화를 이끌어가겠다"고 전했다.
yek105@newspim.com























